Набор реагентов для сайт-направленного мутагенеза Phusion
Описание
Набор рассчитан на проведение 20 экспериментов по сайт-направленному мутагенезу (включая контрольные реакции), а также контрольные плазмиду и праймеры, рассчитанные на 10 реакций.
| Компонент набора |
Набор F-541 20 реакций |
| Высокоточная ДНК-полимераза Phusion Hot Start II, 2 е.а./мкл | 10 мкл |
| 5-тикратный буфер Phusion HF | 1,5 мл |
| Смесь dNTP, концентрация каждого 10 мМ | 20 мкл |
| Контрольная плазмида (в буфере ТЕ), 10 пг/мкл | 20 мкл |
|
Контрольная смесь, содержащая два 5'-фосфорилированных праймера, концентрация каждого праймера 25 мкМ Праймер №1: 5'-рGTCGACTCTAGAGGATCCCCGGGT-3' Праймер №2: 5'-рCTGCAGGCATGTAAGCTTGGCGTA-3' |
10 мкл |
| Т4 ДНК-лигаза | 15 мкл |
| 5-тикратный буфер для ускоренного лигирования | 200 мкл |
Все компоненты набора должны храниться при -20°С.
Набор для сайт-направленного мутагенеза Phusion позволяет получать точечные мутации, делеции или инсерции (вставки) в плазмидной ДНК любого типа. В состав набора входит высокоточная и процессивная ДНК-полимераза Phusion Hot Start II, необходимая для эффективной амплификации плазмидной ДНК с помощью полимеразной цепной реакции.
Преимущества набора.
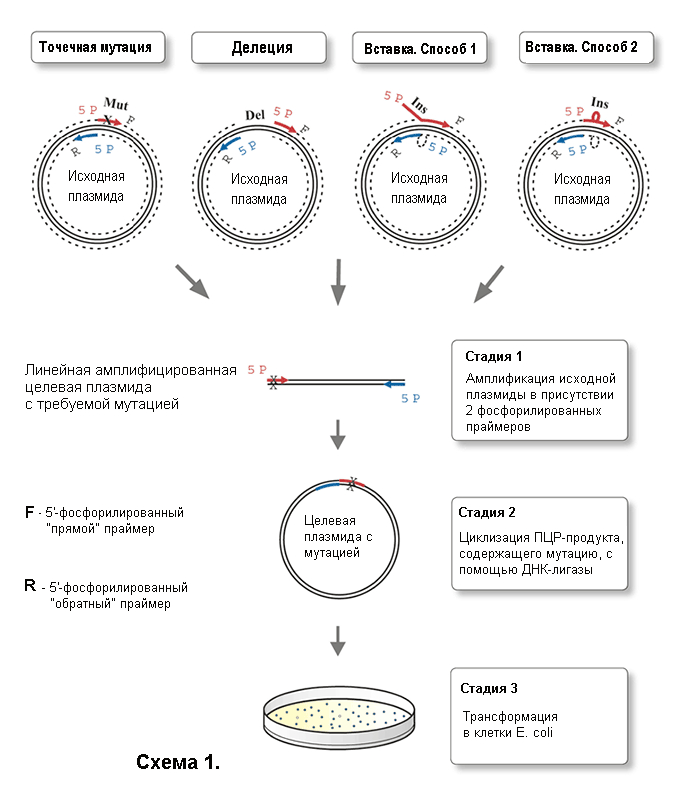
Протокол для проведения мутагенеза включает всего 3 стадии (Схема 1).
Амплификация исходной плазмиды методом ПЦР в присутствии двух фосфорилированных праймеров (один или оба несут мутацию), сконструированных специальным образом («спина к спине»).
Циклизация ПЦР-продукта, содержащего мутацию, с помощью T4 ДНК-лигазы.
Трансформация смеси в клетки E. coli.
В качестве исходной может использоваться любая плазмида. Плазмида не должна содержать специальные векторы, участки узнавания эндонуклеаз рестрикции или иметь особый статус метилирования.
Использование ДНК-полимеразы Phusion Hot Start II позволяет свести к минимуму нежелательные мутации и амплифицировать большие плазмиды (до 10000 пар нуклеотидов). Отличительной особенностью ДНК-полимеразы Phusion Hot Start II является её необычная структура. Кроме области, ответственной за полимеразную активность, фермент содержит обратимо связанный с ним специфический белок Affibody® (Nord et al., Nature Biotechnology, 1997, v. 15, p. 772-777). Белок Affibody® ингибирует синтез ДНК-фрагментов полимеразой и ее 3'-5'-корректирующую активность при температуре окружающей среды, что предотвращает образование неспецифических продуктов, деградацию матрицы и праймеров. При повышенной температуре происходит диссоциация белка Affibody® из комплекса с ДНК-полимеразой Phusion Hot Start II, приводя к полному восстановлению полимеразной активности фермента без каких-либо дополнительных стадий в процессе ПЦР.
В связи с высокой эффективностью амплификации в качестве матрицы для ПЦР используется незначительное количество исходной плазмиды. Таким образом, отсутствует необходимость ее гидролиза.
В набор входит фермент T4 ДНК-лигаза, который позволяет циклизовать мутантную ДНК без дополнительных стадий очистки до и после реакции лигирования.
Целевая плазмида может быть трансформирована в любые компетентные клетки E. coli, имеющиеся в лаборатории.
Препараты, необходимые для проведения эксперимента, но не входящие в состав набора.
- Исходная плазмидная ДНК;
- 5'-Фосфорилированные праймеры;
- Среда SOC и чашки Петри с агаризованной средой LB и антибиотиками;
- 5-Бром-4-хлор-3-индолил-бета-D-галактопиранозид (X-Gal): R0402, R0404;
- Изопропил-бета-D-тиогалактопиранозид (IPTG): R0392, R0393, R0941, R1171.
Основные принципы введения мутаций в ДНК (Схема 1).
Точечные мутации вносят в ДНК путем использования праймера, в котором присутствуют необходимые нуклеотидные замены. При гибридизации праймера с исходной ДНК в местах мутаций образуются некомплементарные пары. Рекомендуемая длина праймеров - 24−30 нуклеотидных звеньев. Вносимая мутация должна находиться примерно в середине цепи праймера, так чтобы с каждой стороны от некомплементарного участка находилось 10−15 канонических пар нуклеотидов.
Делеции создаются в ДНК в результате использования праймеров, которые фланкируют удаляемую область плазмиды с двух сторон. Праймеры длиной 24–30 пар нуклеотидов должны быть полностью комплементарны ДНК-матрице.
Дополнительные нуклеотидные последовательности (вставки) могут быть введены в состав ДНК двумя способами.
При дизайне длинных вставок на 5'-конец одного или обоих праймеров вводят фрагмент нужной последовательности, которая некомплементарна ДНК-матрице. Если такие последовательности вводятся на 5'-конец обоих праймеров, они формируют нужную вставку после лигирования продуктов ПЦР.
При дизайне коротких вставок фрагмент нужной последовательности вводят в центральную часть праймера, так чтобы с каждой стороны от этого участка находилось 10–15 канонических пар нуклеотидов. По крайней мере, 24–30 нуклеотидов, входящих в состав праймера, должны образовывать с ДНК-матрицей комплементарные пары.
 войти
войти

